默克生命科學實驗分享|細菌轉化實驗方案
發布時間:
轉化是分子克隆中的一步關鍵過程,通過它可產生多個拷貝的重組DNA分子。能夠吸收游離的細胞外遺傳物質的能力是采用細菌感受態細胞
轉化是分子克隆中的一步關鍵過程,通過它可產生多個拷貝的重組DNA分子。能夠吸收游離的細胞外遺傳物質的能力是采用細菌感受態細胞進行轉化的前提。目的在于獲得重組質粒上目標序列的復制。了解更多關于默克生命科學的信息,請訪問官網:www.sigmaaldrich.cn
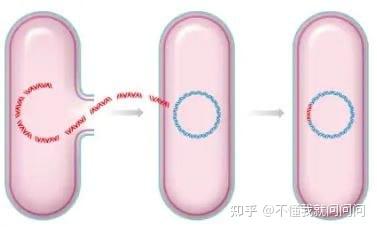
圖 1.轉化
開始轉化之前:
- 準備LB瓊脂板并使其凝固。如果使用預先灌裝板,請確保將板加熱至37 °C。
- 根據質粒DNA中存在的抗生素標記,在LB瓊脂中加入適當的抗生素。
- 如果需要對重組體進行藍/白篩選,則在LB瓊脂中加入1 mM IPTG、300 μg/mL S-Gal或40 μg/mL X-Gal以及500 μg/mL檸檬酸鐵銨。
- 如果使用電轉感受態細胞,請將電穿孔室置于冰上。
- 將水浴加熱至37 °C。
- 將無菌SOC培養基加熱至室溫(或在水浴中升溫至20-25 °C)。
使用化轉感受態細胞轉化的實驗方案
所需材料(未提供):
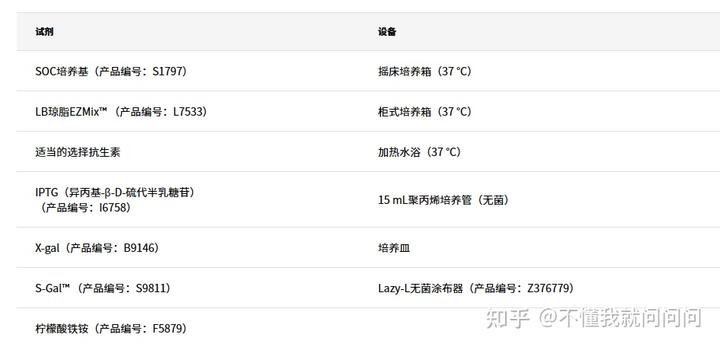
標準轉化實驗方案
- 將所需數量的試管從-70°C冰箱轉移到濕冰中。如果需要,額外取用一個試管用于對照DNA。
- 讓細胞解凍5分鐘。輕彈培養管多次以獲得均勻的懸浮液。
- 對于對照:將1 μL(10 ng)pUC19對照DNA加入一個試管中。輕彈試管以便混合,并置于冰上。
- 將1 ng至50 ng純化的質粒DNA直接加入其余試管的細胞中。輕彈試管以便混合,并置于冰上。
- 將細胞在冰上孵育30分鐘。
- 將細胞轉移到37°C水浴中靜置剛好45秒。
- 將細胞轉移至冰上靜置2分鐘。
- 將SOC培養基添加到每個試管中。將細胞轉移到無菌聚丙烯試管中,并松開蓋子以便培養物通氣。
- 將細胞在搖床培養箱(225-250 rpm)上于37℃孵育1小時。
- 移取10-100 μL每種轉化的細胞懸浮液到含有選擇抗生素的LB瓊脂板上,并用無菌涂布器涂抹。
- 將板在37℃孵育過夜。
- 根據需要選擇一個(多個)菌落和培養物。
- 從每種培養物中分離質粒DNA。
- 培養優選的克隆。
- 使用限制酶消化質粒DNA,用凝膠電泳分離。
使用電轉感受態細胞轉化的實驗方案
所需材料(未提供):
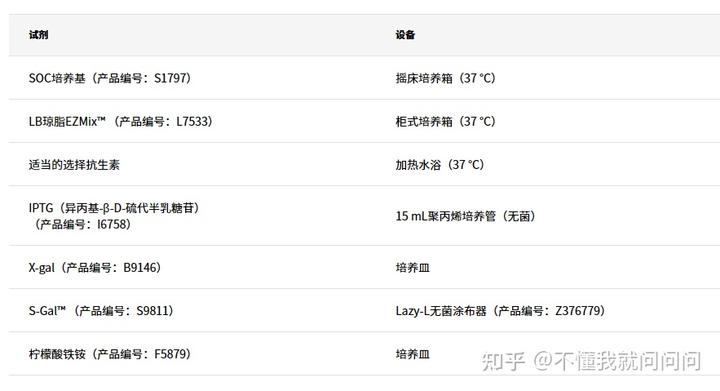
標準轉化實驗方案
- 將所需數量的試管從-70°C冰箱轉移到濕冰中。如果需要,額外取用一個試管用于對照DNA。
- 讓細胞解凍5分鐘。輕彈培養管多次以獲得均勻的懸浮液。
- 將SOC培養基轉移至培養管中,每個轉化反應一個管,并置于室溫下。
(SOC培養基的體積取決于下一步中將要添加的細胞體積。感受態細胞和SOC培養基的最終體積應為1000μL。) - 將1 mm標準比色皿和無菌微量離心管置于冰上,每個轉化反應配一套。
- 將感受態細胞轉移到冷凍的微量離心管中。使用來自80 μL包裝的40 μL細胞以及來自100 μL包裝的50 μL細胞。
- 對于對照:將1 μL的1至5倍稀釋的pUC19對照DNA添加至一個試管中。
- 在TE緩沖液中制備DNA或Ligation Mix的1至5倍的稀釋液。添加至微量離心管中。
- 將DNA和細胞混合物移液到冷凍的1 mm比色皿中。
- 將電穿孔儀設置為25 kV/cm的場強6ms,并處理細胞。
- 從比色皿中取出細胞,添加至含有SOC培養基的試管中。
- 將細胞在搖床培養箱(225-250 rpm)上于37℃孵育1小時。
- 移取10-100 μL每種轉化的細胞懸浮液到含有選擇抗生素的LB瓊脂板上,并用無菌涂布器涂抹。
- 將板在37 ℃孵育過夜。
- 根據需要選擇一個菌落和培養物。
- 從每種培養物中分離質粒DNA。
- 使用限制酶消化質粒DNA,用凝膠電泳分離。
- 培養優選的克隆。
優化轉化過程的重要提示:
- 確認收到時細胞仍處于冷凍狀態,且仍然有干冰。
- 為了獲得最大的轉化效率,請使用不含苯酚、乙醇、蛋白質、鹽或去垢劑的優質DNA樣品。使用電轉感受態細胞時,DNA中的高鹽含量會導致高壓電弧,這可能會損壞樣品和設備。
- 含有優質試劑的連接反應中的DNA可用于轉化。DNA連接酶不需要滅活。
- 始終將感受態細胞保持在冰上,防止細胞意外升溫。
- 輕彈培養管以獲得均勻的細胞懸浮液。請勿使用渦旋或移液器混合。
- 將LB瓊脂板溫熱至37 °C,以獲得最佳的菌落生長。
- 使用電轉感受態細胞進行轉化的電穿孔儀設置:
- BTX Model ECM 630:HV模式,2.5 kV,25 μF,100 Ω,1 mm比色皿
- BioRad基因脈沖發生器:2.5 kV,25 μF,100 Ω,1 mm比色皿









